En esta primera parte se resumirán las principales
propiedades de la luz y la estructura de las moléculas que hacen posible su
interacción y la aparición de toda una serie de fenómenos que pueden
aprovecharse para desarrollar aplicaciones de alto impacto social.
¿Qué es la luz? Si acudiésemos a la teoría defendida por uno
de los colosos de la Historia de la Ciencia, Isaac Newton (Figura 1), diríamos
que la luz está constituida por partículas. Curiosamente, en la misma época, en
la década de 1670, otro científico llamado Christian Huygens (Figura 2), propuso
que la luz estaba constituida por ondas. ¿A quién creer? Posiblemente, muchos
de nosotros caeríamos en el mismo error que se cometió durante años ante esta
cuestión, ya que nuestro criterio quedaría seriamente condicionado ante el
prestigio y la talla de una mente como la de Newton. Desde que fuera planteada
por Newton, la naturaleza corpuscular de la luz fue la teoría comúnmente
aceptada.
 | |
| Figura 1. Isaac Newton, defensor de la teoría corpuscular de la luz | (Fuente: Wikimedia) |
 |
| Figura 2. Christian Huygens, defensor de la teoría ondulatoria de la luz (Fuente: Wikimedia) |
Sin embargo, en 1801, Thomas Young realizó un experimento que
entraba en clara contradicción con las ideas defendidas por Newton. Dicho
experimento consistió en situar una fuente de luz alejada de una barrera opaca
en la que se habían realizado dos pequeñas ranuras. Al observar la imagen
proyectada sobre una pared al otro lado de la barrera, la sorpresa fue
encontrar que no había solamente una zona iluminada por cada una de las
rendijas que habían dejado pasar la luz (Figura 3), sino toda una serie de
regiones iluminadas periódicamente Si la luz hubiera estado constituida por
partículas, el resultado se asemejaría al obtenido si se tuviera arena fina en
una caja en la que en el fondo se hubieran abierto dos ranuras. La arena iría
poco a poco saliendo de la caja, formando dos montículos en el suelo, cada uno
justo debajo de su respectiva ranura.
 |
Figura 3. Experimento de Young bajo el
comportamiento
corpuscular de la luz. (Fuente:
Elaboración propia)
|
Sin embargo, el comportamiento observado por Young encontraba
perfectamente explicación si se suponía que la luz estaba formada por ondas.
Las ondas pueden reducirse de una forma gráfica a una sucesión de crestas y
valles. Cuando dos ondas idénticas viajan de manera que sus crestas coinciden
el resultado es una onda con el doble de amplitud o altura. A este fenómeno se
le llama interferencia constructiva (Figura 4 superior). Si, por el contrario,
cuando una de las ondas se encuentra, por ejemplo, en una de las crestas y la
otra en un valle, el resultado es que ambas ondas se cancelan en un fenómeno
llamado interferencia destructiva (Figura 4 inferior).
 |
Figura 4.
Superior: Interferencia constructiva de dos ondas.
Inferior: Interferencia destructiva de dos
ondas. (Fuente: Elaboración propia)
|
En el caso del experimento realizado por Young, cada una de
las ranuras realizadas en la barrera opaca actuaba como un foco o punto
generador de nuevas ondas, algo contemplado en la teoría defendida por Huygens.
Estas nuevas ondas, al seguir propagándose interferirían entre sí, de modo
constructivo y destructivo. En función del tipo de interferencia, existirían
regiones donde se observaría luz y otras en las que ésta se extinguiría,
justificando el patrón observado por Young (Figura 5)
 |
Figura 5. Experimento de Young bajo el
comportamiento
ondulatorio de la luz. (Fuente: Elaboración propia)
|
En
el siguiente vídeo puede observarse cómo se forman las interferencias
constructivas y destructivas cuando se geenran ondas sobre la superficie
de un estanque. La información más importante está a partir de 4' 30''.
De modo que, 130 años después de que se elaborasen las
primeras teorías sobre la naturaleza de la luz, existían por primera vez
evidencias experimentales de elevado peso a favor del comportamiento
ondulatorio de la luz. Si el S. XVIII había sido favorable a la teoría
corpuscular, el S. XIX se rendía a la naturaleza ondulatoria de la luz. Sería J.
C. Maxwell el encargado de aportar el soporte matemático a esta teoría, donde
la luz se describe como la suma de un campo eléctrico y en campo magnético.
Pero la cuestión parecía que no dejaba de estar del todo
resuelta, especialmente cuando en 1887 Heinrich Hertz descubrió el efecto
fotoeléctrico: cuando un metal se irradia con luz de frecuencia adecuada se
observa la liberación de electrones con una energía cinética característica. Lo
realmente curioso en este experimento es que, para un metal dado, si se
modificaba la intensidad de la luz empleada (la amplitud de la onda o, más
gráficamente, la altura de la cresta de la onda), la energía de los electrones
emitidos no se veía alterada, lo cual no podía ser explicado bajo las premisas
de la teoría ondulatoria de la luz. De nuevo, un gigante de la Historia de la
Ciencia, Albert Einstein, salió en auxilio de la teoría corpuscular. Einstein
desarrolló un modelo matemático por el cual se asumía que la luz constaba de
pequeños paquetes de energía (llamados cuantos de luz, posteriormente
denominados fotones). La energía de estos paquetes estaba relacionada con la
frecuencia de la radiación, por medio de la famosa ecuación de Planck [1] (donde
ν es la frecuencia y h es una constante)
E = h·ν [1]
En este modelo, cada metal tenía un valor umbral
característico llamado función de trabajo (W) que actuaba como límite para
establecer si se emitían o no los electrones. De esta manera, cuando la energía
del fotón de luz es superior a la función de trabajo, dicha energía se reparte
entre liberar los electrones del metal (función de trabajo) y aportar energía
cinética (Ec) al electrón liberado (ecuación [2]).
Efotón
= W + Ec [2]
Dado que la función de trabajo es una constante
característica de cada metal, al aumentar la energía de los fotones aumenta la
energía cinética de los electrones liberados, aunque, como puede verse, la
intensidad de la luz empleada no juega ningún papel. Por la explicación de este
fenómeno, Albert Einstein recibiría el Premio Nobel de Física de 1921.
Comenzaba el S. XX y se volvía prácticamente al punto de
partida, ya que la luz era capaz de comportase como ondas dando lugar a
interferencias como las mostradas en el experimento de la doble rendija de Young
pero también era capaz de intercambiar energía como las partículas, de forma
discreta en forma de paquetes de energía, tal y como demostraba el efecto
fotoeléctrico.
Esta dualidad de la luz, que pasaría a llamarse
onda-corpúsculo, quedó unificada en la hipótesis planteada en 1924 por el
físico francés Louis De Broglie al afirmar que “toda la materia presenta
características tanto ondulatorias como corpusculares comportándose de uno u
otro modo dependiendo del experimento específico”. Matemáticamente
consideró que toda partícula tiene una longitud de onda asociada relacionada
con su momento lineal (producto de la masa (m) por la velocidad (v) con la que
se mueve) según la siguiente ecuación.
El modelo planteado por Einstein para explicar el efecto
fotoeléctrico tenía en consideración las ideas cuánticas imperantes al comienzo
del S. XX. La base de la cuantización de la energía radica en que la energía no
puede adquirir ni puede intercambiarse con cualquier valor, sino con una serie
de valores concretos. Esta idea también se trasladó a la estructura de la
materia, empezando, en primer lugar, por la estructura del átomo. Según los
principios de la teoría cuántica, la energía de los electrones que se
encuentran rodeando al núcleo del átomo sólo puede adquirir unos valores
concretos, tal y como planteó en primer lugar Niels Bohr en su modelo del átomo
de hidrógeno. De una forma visual podría decirse que el átomo sería parecido al
sistema solar, con un núcleo que sería el Sol y los electrones, o planetas,
orbitando alrededor de él (Figura 6).
 |
Figura 6. Estructura
esquemática del modelo atómico de Bohr. (Fuente: Elaboración propia)
|
La cuestión está en que el radio (o energía) de esas órbitas
no podría ser cualquiera, sino aquel que cumpliera una serie de condiciones de
cuantización.
Lo importante es que los electrones podían pasar de un nivel
a otro siempre y cuando cumpliesen que la energía puesta en juego fuese la
diferencia entre la energía de los dos niveles entre los que se produce el
tránsito. Este fenómeno resulta clave para comprender todo lo que se va a
explicar posteriormente sobre la interacción de la radiación con la materia. Lo
único que hay que tener presente es que generalmente nos vamos a referir a
moléculas en vez de átomos. Ciertamente, las moléculas no son más que un conjunto
de átomos unidos por medio de enlaces. En este caso, no se habla de los niveles
de energía que los electrones ocupan en el átomo, sino que solemos referirnos a
los niveles de energía de los electrones en el conjunto de la molécula. Las
transiciones que pueden ocurrir entre estos niveles siguen cumpliendo los
mismos principios vistos hasta ahora.
Con estos elementos, la naturaleza de la luz y la estructura
electrónica de las moléculas en niveles de energía entre los cuales pueden
producirse tránsitos, es posible empezar a construir el edificio sobre el que
se asienta la Fotoquímica.



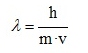
No hay comentarios:
Publicar un comentario